In questa pagina trovate notizie, letteratura scientifica, attualità, rubriche per pazienti e operatori sanitari, campagne informative e iniziative nazionali ed internazionali.
Farmaci biosimilari in Italia: report AIFA aggiornati a novembre 2023
26 Marzo 2024
L’Agenzia pubblica i report sul monitoraggio dei farmaci biosimilari in Italia, aggiornati a novembre 2023.
Nota Informativa Importante su Paxlovid
26 Marzo 2024
Nota informativa importante concordata con le autorità regolatorie europee e l’Agenzia Italiana del Farmaco (AIFA). Paxlovid (nirmatrelvir + ritonavir): raccomandazioni sulle interazioni farmacologiche potenzialmente fatali e fatali con alcuni immunosoppressori, incluso tacrolimus.
Nota Informativa Importante su medicinali contenenti clormadinone acetato/etinilestradiolo.
26 Marzo 2024
Nota informativa importante concordata con le autorità regolatorie europee e l’Agenzia Italiana del Farmaco (AIFA). Contraccettivi ormonali combinati (COC) – clormadinone acetato/etinilestradiolo: rischio leggermente aumentato di tromboembolia venosa nelle donne che usano contraccettivi ormonali combinati a base di clormadinone acetato ed etinilestradiolo.
ARNAS G.Brotzu – Corso ECM Farmacovigilanza e buon uso del farmaco
19 Marzo 2024
4 e 18 Aprile 2024 h 14:50 – 18:00 Il corso, rivolto a Medici, Farmacisti e Infermieri afferenti all’ARNAS G.Brotzu, riguarderà la farmacovigilanza e il buon uso del farmaco. 13,5 CREDITI ECM (MAX 25 PARTECIPANTI) Aula di Anestesia 5°PianoOspedale San MicheleARNAS G. Brotzu
Nota Informativa Importante sui Retinoidi orali (acitretina, alitretinoina e isotretinoina)
19 Marzo 2024
I retinoidi orali sono altamente teratogeni. L’uso dei retinoidi orali è pertanto controindicato in gravidanza e nelle donne potenzialmente fertili, a meno che non siano soddisfatte tutte le condizioni del Programma di Prevenzione della Gravidanza. (Pregnancy Prevention Programme, PPP). Studi recenti condotti in diversi Paesi europei hanno rilevato un basso livello di aderenza alle misure…
Estratto degli highlights della riunione del PRAC del 4-7 marzo 2024
19 Marzo 2024
Si rende disponibile un estratto degli highlights della riunione del Comitato per la valutazione dei rischi in farmacovigilanza (PRAC) del 4-7 marzo 2024.
Nota Informativa Importante sui medicinali contenenti etoposide
5 Marzo 2024
Nota informativa importante concordata con le autorità regolatorie europee e l’Agenzia Italiana del Farmaco (AIFA).
L’utilizzo di approcci scientifici tradizionali e di nuove metodologie per il rilevamento dei segnali in farmacovigilanza.
5 Marzo 2024
Un editoriale scritto da importanti membri del Chapter italiano dell’ISoP (International Society of Pharmacovigilance) su Frontiers in Drug Safety and Regulation.
Nota Informativa Importante su medicinali contenenti valproato
20 Febbraio 2024
Uno studio osservazionale retrospettivo condotto in 3 paesi del Nord Europa suggerisce un aumento del rischio di disturbi del neurosviluppo (NDD, neuro developmental disorders) nei bambini (da 0 a 11 anni) nati da uomini trattati con valproato in monoterapia nei 3 mesi precedenti il concepimento rispetto a quelli nati da uomini trattati con lamotrigina o…
Nota Informativa Importante sui medicinali contenenti pseudoefedrina
20 Febbraio 2024
Sono stati segnalati alcuni casi di sindrome da encefalopatia posteriore reversibile (PRES) e di sindrome da vasocostrizione cerebrale reversibile (RCVS) con l’uso di medicinali contenenti pseudoefedrina. Tali medicinali sono controindicati nei pazienti con ipertensione grave o non controllata, o con malattia renale o insufficienza renale acuta o cronica, poiché queste condizioni aumentano i rischi di…
Paxlovid: richiamo a reazioni avverse gravi se assunto insieme ad alcuni immunosoppressori
20 Febbraio 2024
Si rende disponibile in allegato un estratto degli highlights della riunione del Comitato per la valutazione dei rischi in farmacovigilanza (PRAC) del 5-8 febbraio 2024.
Il CRFV Sardegna pubblica il report annuale di attività relativo al 2023.
6 Febbraio 2024
Il Centro Regionale di Farmacovigilanza (CRFV) ha raggiunto gli obiettivi assegnati dalla Regione Sardegna per il 2023, registrando 576 segnalazioni di sospetta Reazione Avversa a Farmaco (ADR), di cui 66 a vaccini e 510 a farmaci, inserite dalla Sardegna nella Rete Nazionale di Farmacovigilanza dal 1° gennaio al 31 dicembre 2023. Si evidenzia un calo…
Il PRAC pubblica il work plan 2024: focus sull’attività di farmacovigilanza e sull’innovazione terapeutica.
6 Febbraio 2024
Il Comitato di valutazione dei rischi per la farmacovigilanza (Pharmacovigilance Risk Assessment Committee – PRAC) dell’EMA ha adottato il proprio piano di lavoro per l’anno 2024.
Farmaci biosimilari in Italia: report AIFA aggiornati a settembre 2023
6 Febbraio 2024
L’Agenzia pubblica i report sul monitoraggio dei farmaci biosimilari in Italia, aggiornati a settembre 2023.
L’EMA conferma la raccomandazione di non rinnovare l’autorizzazione di Translarna per la distrofia muscolare di Duchenne
6 Febbraio 2024
Dopo aver condotto il riesame, il Comitato per i medicinali per uso umano (CHMP) di EMA ha confermato la propria raccomandazione iniziale di non rinnovare l’autorizzazione all’immissione in commercio (AIC) subordinata a condizioni di Translarna (ataluren).
EMA conferma le misure per ridurre al minimo il rischio di effetti collaterali gravi con i prodotti medicinali contenenti pseudoefedrina
30 Gennaio 2024
Il 25 gennaio 2024, il Comitato per i medicinali per uso umano dell’EMA (CHMP) ha approvato le misure raccomandate dal Comitato di valutazione dei rischi per la farmacovigilanza (PRAC) per ridurre al minimo i rischi di sindrome da encefalopatia posteriore reversibile (PRES) e sindrome da vasocostrizione cerebrale reversibile (RCVS) per i medicinali contenenti pseudoefedrina.
Misure precauzionali per gestire il rischio potenziale di disturbi del neurosviluppo in bambini nati da uomini trattati con medicinali contenenti valproato
30 Gennaio 2024
Il 24 gennaio 2024, il CMDh (Gruppo di coordinamento per le procedure di mutuo riconoscimento e decentrate) ha approvato le misure precauzionali raccomandate dal Comitato di sicurezza dell’EMA (PRAC) relative al trattamento dei pazienti di sesso maschile con medicinali contenenti valproato.
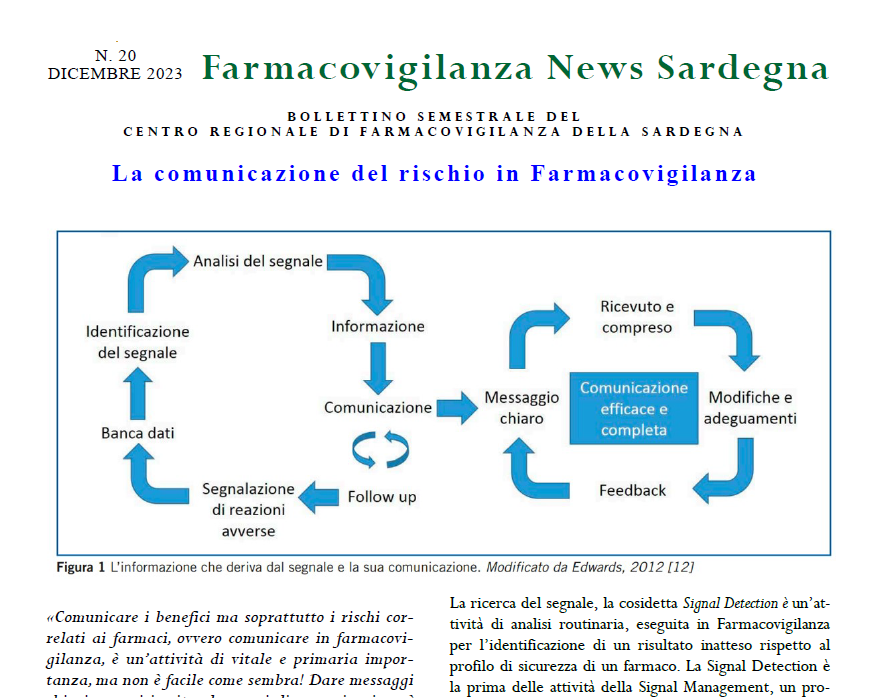
Il CRFV pubblica il Bollettino semestrale di Dicembre 2023
25 Gennaio 2024
Il nuovo numero del Bollettino di Farmacovigilanza del Centro Regionale della Sardegna è incentrato sulla comunicazione del rischio in Farmacovigilanza.Vista l’attualità e l’importanza degli argomenti trattati, nel bollettino è stata descritta fedelmente la giornata del Simposio “10 anni di Farmacovigilanza in Sardegna”, evento molto partecipato del 17 novembre 2023 che si è tenuto a Monserrato…
EMA conferma la raccomandazione di non rinnovare l’autorizzazione all’immissione in commercio di Blenrep, un medicinale per il mieloma multiplo
23 Gennaio 2024
In data 15 dicembre 2023 il Comitato per i medicinali per uso umano (CHMP – Committee for Medicinal Products for Human Use) dell’EMA ha confermato la sua raccomandazione iniziale di non rinnovare l’autorizzazione all’immissione in commercio (AIC) subordinata a condizioni di Blenrep (belantamab mafodotin) perché i dati aggiornati non hanno confermato l’efficacia del medicinale. Pertanto,…
Avvio della revisione di sicurezza sui medicinali a base di cellule CAR T
16 Gennaio 2024
Il PRAC ha avviato una procedura di analisi del segnale per rivalutare i dati sui tumori maligni correlati alle cellule T, compresi il linfoma a cellule T e la leucemia, per i sei medicinali recettori dell’antigene chimerico (CAR) a base di cellule T approvati, che rientrano nell’ambito delle immunoterapie antitumorali personalizzate in cui i globuli…