Metodi.
Gli autori hanno analizzato i farmaci sospesi dal mercato tra il 1990 e il 2010. Tutte le Agenzie Regolatorie dei farmaci che fanno parte del programma per Monitoraggio Internazionale dei Farmaci (Program for International Drug Monitoring) dell’Organizzazione Mondiale della Sanità (OMS) sono state contattate. Per avere una maggiore completezza dei dati, sono stati analizzati Medline, libri di riferimento e database dei farmaci. Le fonti di informazione sulle quali le autorità basano i motivi della sospensione sono state categorizzate ed è stato poi calcolato il tempo medio tra la data della prima esposizione dei soggetti al farmaco e il momento della sospensione.
Risultati.
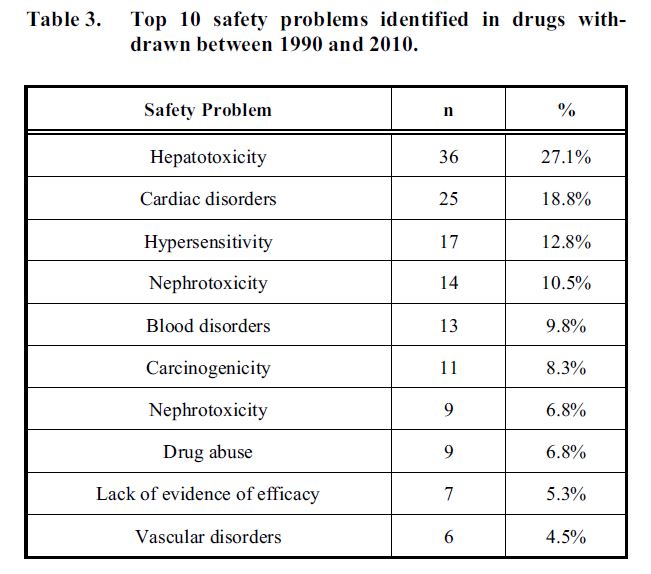
Un totale di 133 farmaci che rispondevano ai criteri di inclusione e di esclusione sono stati sospesi dal mercato per ragioni di sicurezza nel periodo oggetto della presente revisione (1990 – 2010). Le ragioni principali responsabili della sospensione del 69,2 % di tutti i farmaci sono state le seguenti: epatotossicità (n=36, 27.1%), disordini cardiaci (n=25, 18.8%), ipersensibilità (n=17, 12.8%) e nefrotossicità (n=14, 9.8%).
Nella maggior parte dei casi, le fonti di informazione determinanti per la sospensione dei farmaci consistevano in segnalazioni spontanee e/o in case reports (n=86, 64.7%), seguite da segnalazioni provenienti da studi clinici (n=24, 18.0%). Il tempo medio tra l’introduzione di un farmaco nel mercato e la sua sospensione definitiva per motivi di sicurezza è stata di circa 20.3 anni (SD±13.8).
Discussione e conclusioni.
Sulla base delle evidenze disponibili e pubblicate, non esiste un metodo gold standard per identificare i rischi associati all’esposizione ai farmaci. I dati riportati dagli autori sottolineano il ruolo che le differenti fonti di informazione giocano nel contribuire al processo di revisione della sicurezza dei farmaci.
Un ruolo fondamentale è rivestito chiaramente dalla segnalazione spontanea e dai case report che contribuiscono alla comunicazione delle informazioni di sicurezza per quasi i 2/3 di tutte le fonti disponibili. Ciò attribuisce nuovamente un ruolo essenziale ai sistemi di farmacovigilanza nazionali nel reperimento di tali informazioni sulla sicurezza dei farmaci.
Le principali 10 ragioni di ritiro dei farmaci dal mercato:
Bibliografia.
Nuno Sales Craveiro*, Bruno Silva Lopes, Lara Tomás and Sofia Fraga Almeida, “Drug Withdrawal Due to Safety: A Review of the Data Supporting Withdrawal Decision”, Current Drug Safety (2020) 15: 4. E’ possibile leggere l’articolo completo qui