Uno studio prospettico non interventistico OCEAN, pubblicato recentemente sulla rivista Journal of Ophtalmology, ha valutato la sicurezza delle iniezioni intravitreali di ranibizumab per il trattamento della degenerazione maculare neovascolare legata all’età, dell’edema maculare diabetico e dell’occlusione della vena retinica in condizioni reali in Germania.
Sebbene i farmaci anti-VEGF per il trattamento delle condizioni retiniche siano in generale ben tollerati, è noto che dopo iniezioni intravitreali si verificano una serie di eventi avversi oculari (EA).
Lo studio OCEAN prospettico, multicentrico e non interventistico è stato progettato per valutare i risultati delle iniezioni intravitreali di ranibizumab negli adulti con degenerazione maculare neovascolare (nAMD), edema maculare diabetico (DME), occlusione della vena retinica (RVO) o neovascolarizzazione coroideale miope (mCNV) nella pratica clinica di routine in Germania.
Lo studio è stato condotto tra dicembre 2011 e dicembre 2016, con un periodo di osservazione fino a 24 mesi per paziente.
Gli eventi avversi e le reazioni avverse sono stati differenziati in eventi avversi gravi (SAE) o ADR gravi (sADR) e eventi avversi non gravi (nsAE) o ADR non gravi (nsADR).
Il set di valutazione della sicurezza (SES) includeva pazienti con documentazione di almeno un’iniezione di ranibizumab 0,5 mg durante lo studio e per i quali erano disponibili informazioni di follow-up sulla sicurezza (≥1 visita di follow-up o insorgenza di eventi avversi o interruzione prematura).
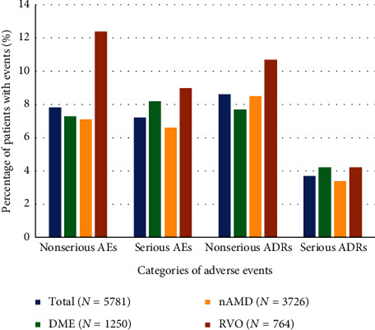
Un totale di 369 oftalmologi (siti di studio) hanno partecipato allo studio OCEAN. Tutti i 5.781 pazienti trattati nello studio sono stati inclusi nel SES per l’analisi corrente. Il SES includeva 3.726 pazienti con nAMD, 1.250 pazienti con DME, 764 pazienti con RVO e 40 pazienti con mCNV.
Durante lo studio, sono stati segnalati un totale di 2.687 eventi avversi (non gravi o gravi) per 1.176 dei 5.781 pazienti nella popolazione di sicurezza (20,3%).
Di questi, il 27,4% erano eventi avversi non gravi (nsAE), il 30,3% erano eventi avversi gravi (SAE), il 27,3% erano reazioni avverse non gravi (nsADR) e il 15,0% erano reazioni avverse gravi (sADR).
Da una prospettiva basata sul paziente, il 7,8% ha riportato eventi avversi non gravi (nsAE), il 7,2% eventi avversi gravi (SAE), l’8,6% ha riportato reazioni avverse non gravi (nsADR) e il 3,7% reazioni avverse gravi (sADR).
Nel complesso, la maggior parte dei pazienti non ha riportato eventi avversi (79,7%) o solo 1 evento avverso (10,3%). Sono state somministrate 32.621 iniezioni.
Il numero di AE, SAE e nsADR differiva leggermente tra le tre indicazioni principali trattate nello studio.
Gli eventi avversi sono stati inoltre analizzati in base al numero di iniezioni di ranibizumab somministrate al rispettivo paziente prima dell’inizio dell’AE.
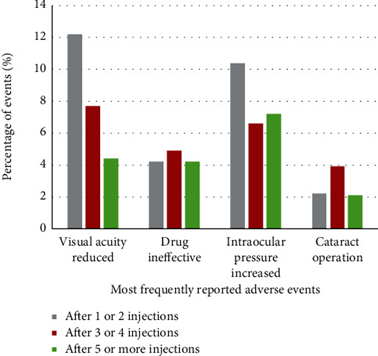
In generale, gli eventi avversi si sono verificati più frequentemente dopo 3 o 4 iniezioni (1.129 eventi avversi su 2.687 per 5.114 pazienti), seguiti da 5 o più iniezioni (859 eventi avversi per 2.912 pazienti) e 1 o 2 iniezioni (596 eventi avversi per 5.781 pazienti).
Nel corso dello studio è stata osservata una diminuzione dei tassi complessivi di EA. Il tasso di incidenza di eventi avversi nel SOC MedDRA Disturbi oculari è stato più alto nei primi tre mesi dello studio, ma è rimasto abbastanza costante nel restante periodo di osservazione.
I risultati non hanno sollevato nuovi problemi di sicurezza per ranibizumab. I risultati consentono di trarre conclusioni su come raccogliere i dati di farmacovigilanza in modo ancora più efficace negli studi del mondo reale per facilitare la discussione sul rapporto rischio-beneficio.
Visualizza l’articolo qui.




