Introduzione
Gli anticoagulanti orali diretti (DOAC) hanno ampiamente rimpiazzato gli antagonisti della vitamina K per molte indicazioni terapeutiche. Sono attualmente prescritti a milioni di pazienti, incluse donne in età riproduttiva. L’esposizione ai DOAC nelle prime fasi della gravidanza non è comune, tuttavia i dati sui rischi di tossicità embrionale sono scarsi. Gli autori hanno valutato il rischio teratogeno in un ampio campione di casi riportati.
Metodi
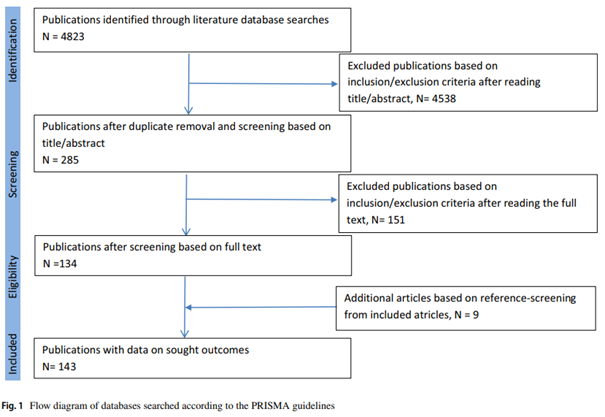
In questo studio di coorte retrospettivo gli autori hanno raccolto segnalazioni di casi clinici di esposizione ai DOAC in gravidanza ottenuti da ginecologi, ematologi e specialisti vascolari a partire dal maggio 2015. Gli autori hanno poi esportato i dati dai database di farmacovigilanza dei produttori di DOAC, dell’Agenzia Europea del Farmaco, dall’Autorità tedesca sui farmaci e dall’americana Food and Drug Administration, cercando segnalazioni di esposizione in gravidanza. Sono stati ottenuti dati dal registro dell’International Society of Thrombosis and Haemostasis (ISTH) e dal Teratology Information Service (TIS) di Ulm in Germania. È stata poi condotta una ricerca sistematica in letteratura nel luglio 2020 per individuare casi di esposizione ai DOAC. I dati sono stati confrontati con quelli già in possesso dagli autori del 2016 e sono stati esclusi duplicati. Le anomalie fetali o neonatali sono state classificate come difetti maggiori alla nascita secondo la classificazione European Concerted Action on Congenital Anomalies and Twins (EUROCAT) e giudicati in quattro categorie in relazione all’esposizione ai DOAC come probabile, possibile, improbabile o non correlato.
Risultati
Gli autori hanno identificato 1193 segnalazioni di esposizione ai DOAC durante la gravidanza; 49 riportate dai medici, 48 dal registro ISTH, 29 dal TIS, 62 dall’Autorità tedesca dei farmaci, 536 da Bayer (estratti dal sistema di farmacovigilanza della Bayer, da VigiBase dell’OMS e dal Sistema di Segnalazione degli eventi avversi di FDA), 87 da Boehringer Ingelheim, 16 da Daiichi Sankyo, 98 dalla ricerca in letteratura, 2 dalla FDA, 10 dal Risk Evaluation Strategy Review, e 256 dalle segnalazioni dell’EMA. Dopo aver escluso i potenziali duplicati, sono stati identificati 614 casi unici di esposizione ai DOAC in gravidanza che si sono verificate tra il 1° febbraio 2007 e il 9 luglio 2020. Esse riguardavano il rivaroxaban in 505 (82%) gravidanze, dabigatran in 36 (6%), apixaban in 50 (8%) e edoxaban in 23 (4%) gravidanze. La durata dell’esposizione mediana ai DOAC in gravidanza è stata di 5,3 settimane (IQR 4,0 – 7,0). Le informazioni sull’esito delle gravidanze erano disponibili per 336 (55%) su 614 gravidanze: 188 (56%) di neonati nati vivi, 74 (22%) di aborto spontaneo, 74 (22%) di aborto indotto. Tra le 336 gravidanze di cui era noto l’esito, 21 (6%; CI 4-9) hanno manifestato anomalie fetali, tra le quali 12 (4%; 2-6) sono state giudicate come difetti congeniti maggiori, che potrebbero essere potenzialmente correlati all’esposizione ai DOAC in gravidanza.
Interpretazione
Sebbene le segnalazioni di eventi avversi in seguito all’esposizione in gravidanza ai DOAC siano carenti per quanto riguarda importanti dettagli e si riferiscono principalmente all’esposizione al rivaroxaban, i dati al momento disponibili non suggeriscono che l’utilizzo degli anticoagulanti DOAC in gravidanza determini un maggior rischio di patologie embrionali. Le linee guida ISTH del 2016 sconsigliano l’induzione dell’aborto in caso di esposizione ai nuovi anticoagulanti orali in gravidanza, in quanto la paura di una possibile tossicità embrionale non è giustificata. Viene invece raccomandata una stretta sorveglianza della gravidanza. Infine, i dati sull’esito delle gravidanze provenienti dai database di farmacovigilanza sono insufficienti perciò vi è la necessità di un miglior sistema di segnalazione.
Bibliografia
Beyer-Westendorf J, Tittl L, Bistervels I, Middeldorp S, Schaefer C, Paulus W, Thomas W, Kemkes-Matthes B, Marten S, Bornhauser M. Safety of direct oral anticoagulant exposure during pregnancy: a retrospective cohort study. Lancet Haematol. 2020 Dec;7(12): e884-e891. PMID: 33242445.
E’ possibile leggere l’abstract originale dell’articolo qui.