I vaccini contro il COVID-19 sono in fase di sviluppo ad una velocità mai vista in precedenza. Ciò pone particolari sfide, che non hanno precedenti, ai sistemi di monitoraggio post-marketing dalla sicurezza. Inoltre, anche la comunicazione sulla sicurezza vaccinale dovrà essere gestita in modo appropriato.
Per impiegare velocemente tali nuovi vaccini in popolazioni diverse è essenziale disporre di un robusto sistema di farmacovigilanza e un sistema di sorveglianza attiva. Non tutti i paesi del mondo hanno la capacità o le risorse per mettere in atto un’adeguata sorveglianza e riceveranno i dati da coloro che invece possiedono tali sistemi.
Gli strumenti per valutare i vaccini per il COVID-19 esistono già e verranno impiegati così come attualmente viene fatto: si tratta dei sistemi di sorveglianza nazionale, dei dati provenienti da fonti amministrative e la definizione dei casi come eventi avversi di speciale interesse.
Tuttavia, tenere insieme tutti questi strumenti e usarli in modo efficace è una sfida che richiede investimenti e collaborazione tra tutti gli attori in gioco. Il presente articolo fornisce una panoramica di alto livello di tutte le sfaccettature della moderna metodologia di valutazione della sicurezza dei vaccini e fornisce indicazioni sul modo con cui questi metodi sono o possono essere applicati ai vaccini nei confronti del COVID-19.
Lo sviluppo di un potenziale candidato vaccino deve essere in primo luogo valutato negli animali per quanto riguarda la sicurezza, l’immunogenicità e l’efficacia. Le problematiche di sicurezza identificate in precedenza nei primi vaccini per la SARS non sono state finora osservate negli studi sull’uomo ma sottolineano l’importanza di scegliere degli approcci vaccinali e degli adiuvanti che producano le risposte desiderate. Le tre fasi di sviluppo clinico nell’uomo sono attentamente condotte in modo tale che solamente con la dimostrazione di risultati favorevoli in una fase è possibile passare a quella successiva. Inoltre, le sperimentazioni cliniche sono sottoposte ad un comitato di esperti indipendente.
Dal punto di vista regolatorio esiste dal 1999 un Comitato dell’Organizzazione Mondiale della Sanità per la sicurezza dei vaccini (World Health Organization Global Advisory Committee on Vaccine Safety) così come un gruppo di esperti (Strategic Advisory Group of Experts) che riceve i risultati portati dall’altro comitato e formula le raccomandazioni.
La Brighton Collaboration è una collaborazione internazionale lanciata nel 1999 che ha come compito quello di sviluppare le definizioni e le linee guida per i potenziali eventi avversi successivi ad immunizzazione. Tali strumenti includono anche la definizione degli eventi avversi di speciale interesse, che devono essere rapidamente comunicati alle parti regolatorie.
Un ruolo fondamentale di tutela dei consumatori è svolto dalle Agenzie Regolatorie, tra cui l’americana Food and Drug Administration e l’Agenzia Europea del Farmaco. Inoltre, un compito centrale è assegnato ai sistemi nazionali di sorveglianza passiva che riportano in ultima istanza al WHO Pharmacovigilance Centre in Uppsala, Svezia. Esistono poi dei programmi di sorveglianza attiva e studi di fase IV che sono in grado di monitorare in tempo quasi reale la popolazione di interesse oltre che mappare l’esposizione ai vaccini.
Esistono numerose sfide in tal senso, per esempio il fatto che ad oggi ancora troppo pochi paesi del mondo possiedono dei sistemi di farmacovigilanza altamente funzionanti. Infine è necessario un forte supporto e una stretta collaborazione tra tutti gli attori implicati nella sfida di monitorare attivamente i vaccini contro il COVID-19
Bibliografia.
Petousis-Harris, H. Assessing the Safety of COVID-19 Vaccines: A Primer. Drug Saf (2020).
E’ possibile leggere l’articolo completo qui.




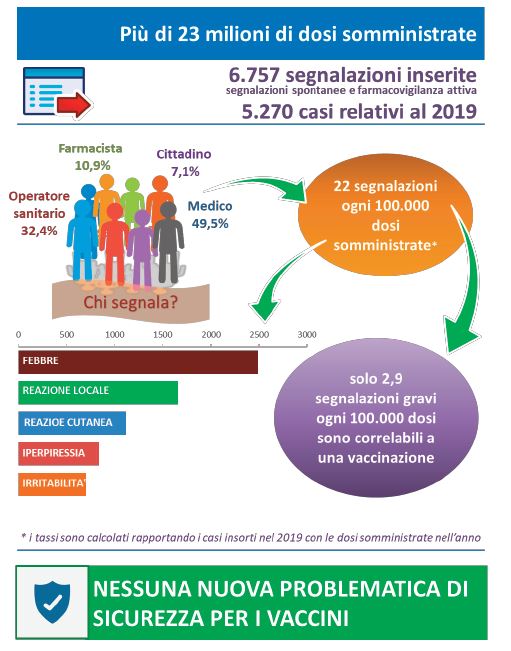

 Un gruppo di ricercatori italiani afferenti all’Università di Verona in collaborazione con l’Agenzia Italiana del Farmaco ha utilizzato il Sistema Italiano di Farmacovigilanza per analizzare le reazioni avverse ai vaccini riportate in un periodo di 10 anni (2008 – 2017).
Un gruppo di ricercatori italiani afferenti all’Università di Verona in collaborazione con l’Agenzia Italiana del Farmaco ha utilizzato il Sistema Italiano di Farmacovigilanza per analizzare le reazioni avverse ai vaccini riportate in un periodo di 10 anni (2008 – 2017).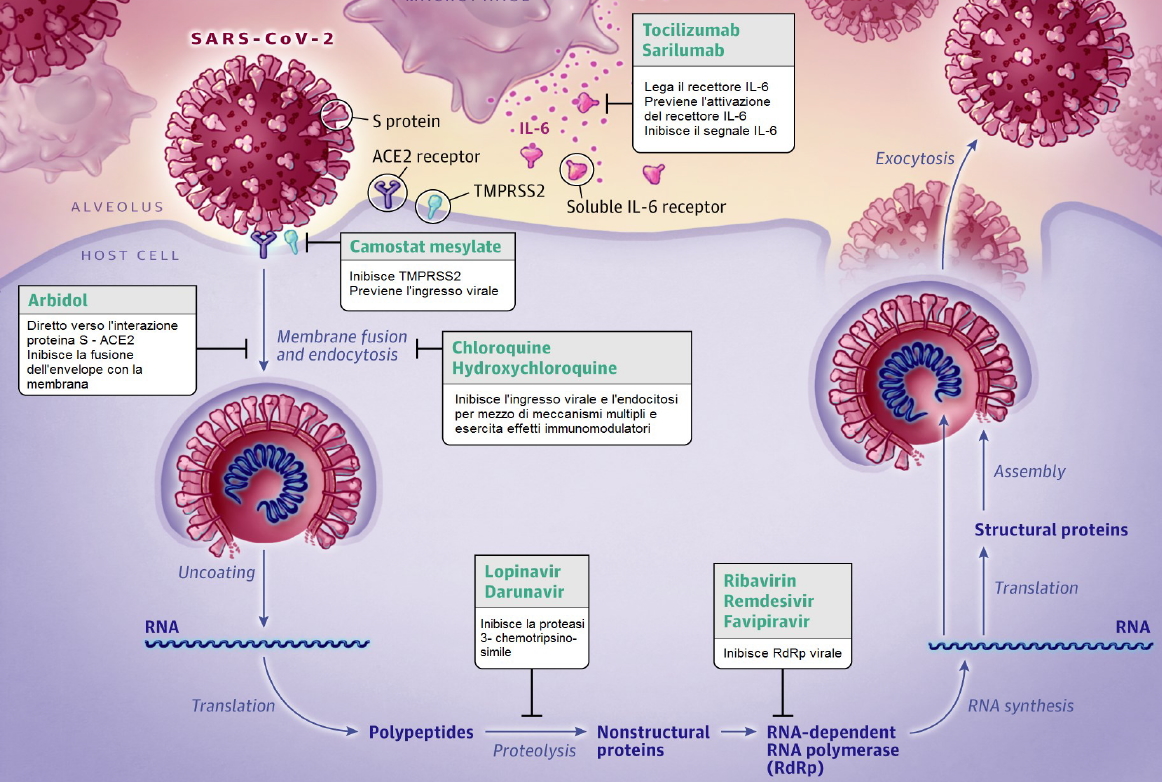
 Pubblicato online il Bollettino News del Centro Regionale di Farmacovigilanza Sardegna di luglio 2020, in cui si descrive lo stato dell’arte sulla ricerca in corso nell’ambito del COVID-19 in quanto a sperimentazioni cliniche e vaccini.
Pubblicato online il Bollettino News del Centro Regionale di Farmacovigilanza Sardegna di luglio 2020, in cui si descrive lo stato dell’arte sulla ricerca in corso nell’ambito del COVID-19 in quanto a sperimentazioni cliniche e vaccini.